如何选择FDA早期沟通交流会议助推新药开发?

美国FDA在药物开发过程中不仅仅扮演着监管者的角色,同时也是申办方药物开发的主动协助者,因此对于开发者而言,高效且有效地与FDA开展沟通交流是尤为重要的。到目前为止,FDA常规的正式沟通交流会议共有五类,分别是A、B、C和D类与INTERACT会议。除此之外,还有一些非常规会议类型,如CBER先进技术团队 (CATT)会议、新兴技术项目 (ETP) 和关键路径创新会议 (CPIM)等。
在规划项目早期沟通时,申请人在INTERACT、Type D 以及Pre-IND会议的选择上,时常存在困惑,难以明确应申请哪种会议。另外,申请人对于INTERACT与Pre-IND会议之间的时间节点和会议内容往往很难把握准确,从而错失最佳的沟通时机。本文中,我们将阐述如何在项目研发早期阶段选择与FDA开展的会议类型,以及对其它非常规会议做一个梳理。
会议目的
INTERACT全称是INitial Targeted Engagement for Regulatory Advice on CBER/CDER producTs,旨在针对在早期开发阶段(IND递交之前,且尚未达到PIND阶段)呈现独特挑战的新型产品和开发项目。
Pre-IND全称是Pre-Investigational New Drug Application,属于Type B会议,旨在帮助申请人在进行IND递交之前,与FDA就启动人体试验所需的各项研究与其各专业审评中心达成共识。
Type D会议通常专注于较为有限的讨论话题。申请人可以在产品开发的任何阶段申请开展Type D会议,包括产品的早期开发阶段。
CATT全称 “CBER Advanced Technology Team” , 是为了促进CBER与先进制造和测试技术的创新开发人员之间的沟通交流,以帮助这些先进技术在CBER监管的生物产品开发中得到充分应用。因此CATT适用于产品开发初期阶段的沟通交流。
ETP全称 “Emerging Technology Program” ,旨在讨论CDER监管下的新型先进制造、检测与质量控制技术开发过程中的监管问题。可用于早期沟通交流,但并不完全局限于产品的早期开发阶段。
会议适用范围
申请人应尽早根据自己的需求匹配合适的会议类型(表1),以避免不必要的耗时或陷入代价高昂的困境之中。
表 1各类沟通交流会议适用范围和注意事项
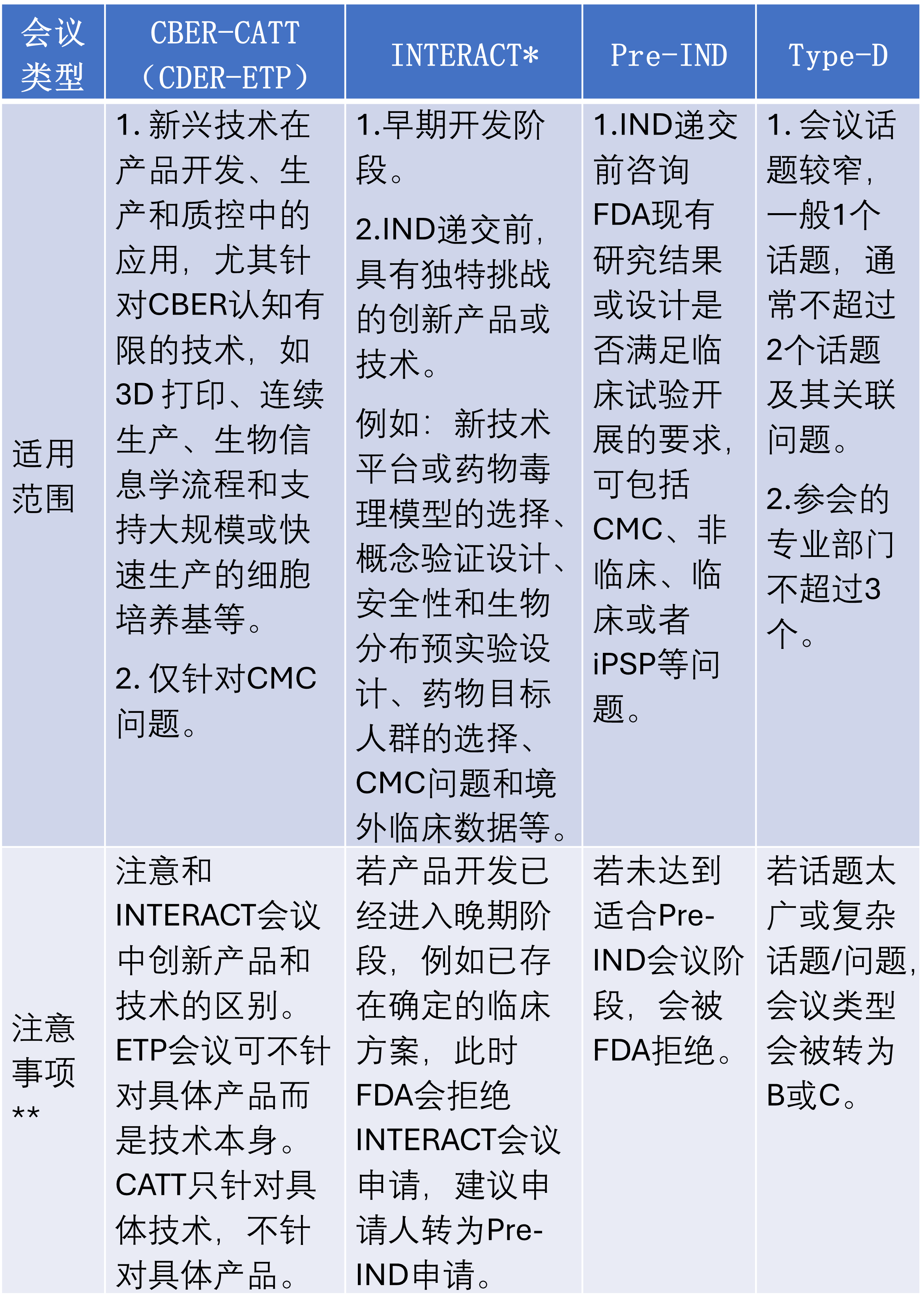
*INTERACT早期是CBER 与创新生物制品申办方之间的非正式会议,尤其是针对ATMPs类产品,目前该会议已扩展至CDER。
**一般来说早期产品应谨慎和注意可以申请的会议次数,整体而言CBER仅有1次Pre-IND会议机会,CDER可以获取2次Pre-IND会议机会。而在Pre-IND之前,一般只有1次INTERACT会议机会。
时间因素也是会议类型选择的一个重要考量(表 2)。
表2:各类会议流程时长
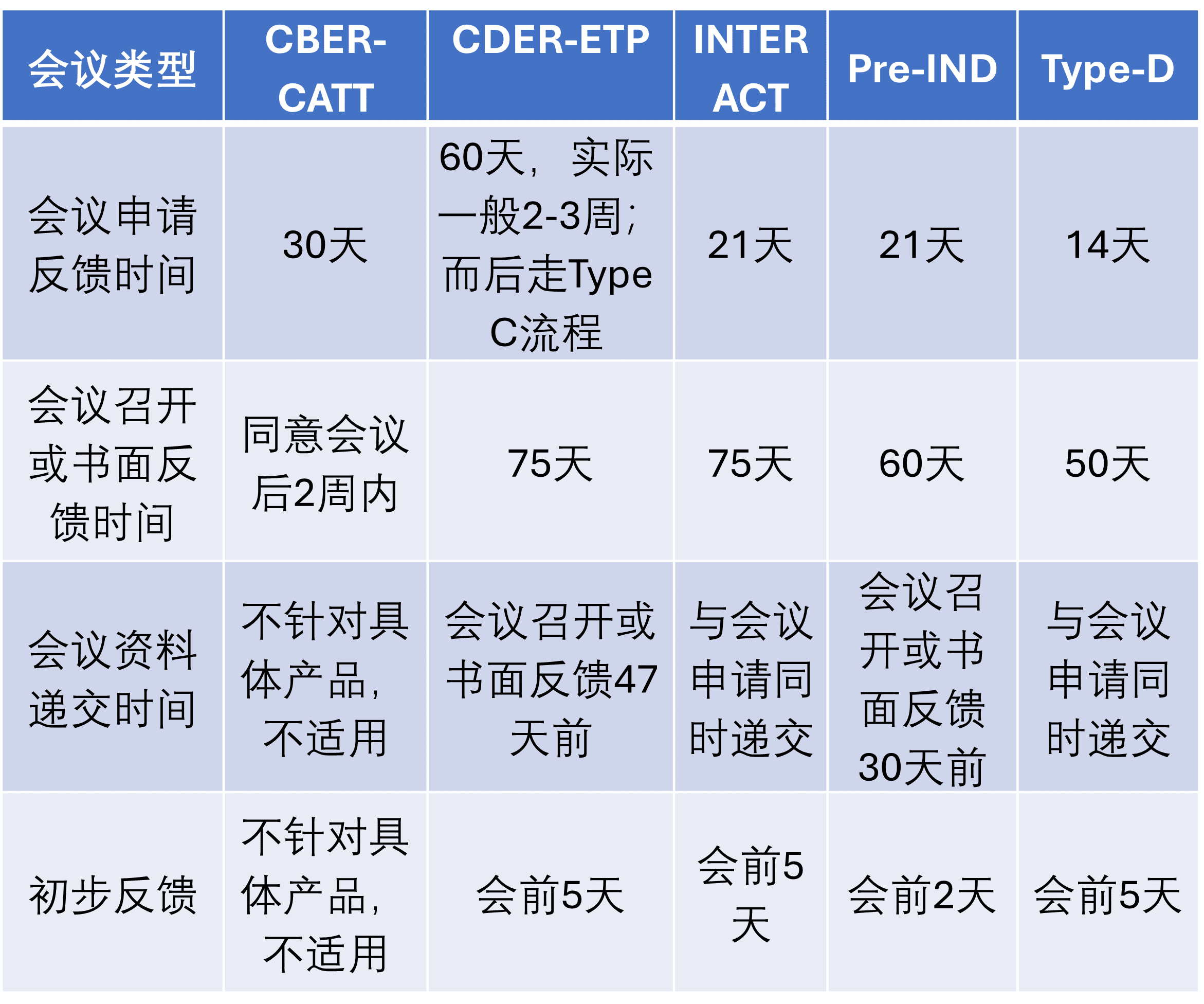
这里值得注意的是,近年来,FDA允许申请人在收到会议纪要或书面回复后提出澄清性问题(Written Follow-up Opportunity),这些澄清性问题必须在收到会议纪要或书面回复后的20天内被正式提交给FDA,然后FDA将在收到澄清性问题后的20天内以书面形式回复。
对于FDA反馈时限,根据FDA PDUFA Reauthorization Performance Goals and Procedures Fiscal Years 2023 through 2027 显示,D类与INTERACT是在近期才开始按PDUFA管理,因此目前在按时反馈率上较常规会议略低,对于A、B和C类会议,FDA按时反馈率是90%,而对于D类和INTERACT会议的按时反馈率,FDA希望在2024年、2025年和2027年能分别达到60%、70%和90%。而非正式会议CATT和ETP则未纳入统计和计划要求中。
总结与建议
通过对上述会议类型的对比性介绍可以看出:INTERACT问题强调的是“早期”和“创新”的属性,Type-D问题强调的则是“单一”和“窄”的属性,而Pre-IND问题则侧重于IND申请阶段,但三者又有一定的交叉度。对于非正式会议,CBER的CATT和CDER的ETP强调 “新兴技术” 在CMC中的应用,可以不针对具体产品开发项目。
对此我们给出的总结是:申请人应结合产品开发计划和沟通交流的问题内容和属性,合理选择和匹配会议类型:
- 如果您希望就CBER的创新技术平台问题进行咨询,且不涉及特定产品,同时希望快速获得FDA的指导和反馈,可选择非正式的CATT会议进行沟通交流;如果您的咨询同时针对某一具体产品开发,可以申请INTERACT会议。
- 如果您想就CDER的新兴技术平台问题进行咨询,并且对时间没有特别紧迫的要求,可以申请耗时较长的ETP会议;如果您的时间较为紧迫,也可以尝试选择Type D会议。
对于具体产品而言,如果您处于较为早期的新型产品和新技术阶段,INTERACT会议是一个合适的选择。如果您已经完成了概念验证,并且已经有了初步的临床开发计划,那么Pre-IND会议将更适合您的需求。然而,无论何时,如果您只针对一两个不复杂但关键的问题,即使是在产品开发的早期阶段,都可以选择Type D会议与FDA进行沟通。

如您有任何问题,您可以随时联系我司专家,获取相关解答
这个世界上不存在完全相同的产品开发流程。欢迎与我们的专家团队探讨您在产品开发中遇到的挑战,我们将为您提供针对性建议。
