
关于PSA
作为全球主要的两大监管机构,FDA和EMA始终致力于为创新产品开发提供监管路径和技术层面支持。一般来说,由于地域差异、规范和用语习惯方面的差异,开发者需要针对两地市场进行定制化开发策略的制定。然而,在某些情况下,开发者可以同时从这两个机构获得关于产品开发计划的一致性科学建议。
为了满足这一需求,EMA和FDA通力合作,在2005年启动了一个由开发者发起的、特定于产品的交流项目:并行科学建议(Parallel Scientific Advice Program, PSA)计划。PSA为EMA和FDA提供了一种全新机制,根据开发者的要求,在创新产品(药物、生物制品、疫苗和先进疗法)开发期间,就科学问题同时向开发者提供建议。重要的是,作为流程的一部分,这两个机构会在与开发者进行会议之前进行磋商以交换意见。
PSA项目主要希望达到4个方面的目标: 从创新产品生命周期的早期就能强化两个机构和开发者之间的沟通;使开发者对监管机构决策的理论依据有更深刻的理解;优化产品开发流程;避免不必要的多余测试。
过往五年内的PSA成果回顾
FDA和EMA共同在最近一期的《Therapeutic Innovation & Regulatory Science》发表了一项对PSA项目过去五年的回顾研究。在2017-2021年间,他们一共收到了37份PSA申请,其中26份(70%)最终被接受。在这五年期间,有四个开发者撤回了他们提交的申请,剩下22个得到了来自FDA和EMA的答复。
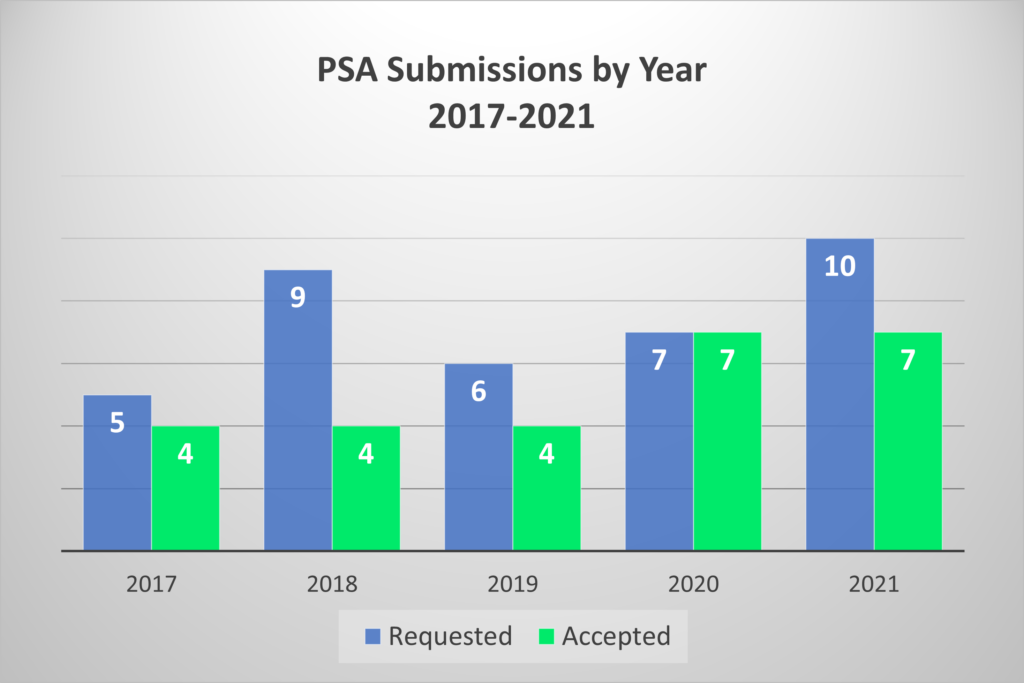
由上图可以看出,PSA项目的接受度是有限的–在过去5年中,每年只有4到7个申请会被接受。
此外,23%被接受的PSA申请属于同一个类别,该类别结合了来自胃肠科、先天性代谢紊乱、罕见病和医学遗传学等方面。其他被接受的申请来自肿瘤学、抗感染药物、心脏病学、肾脏病学以及神经病学等。对2017-2021年间被拒绝的11个申请进行的调查显示,其中4个申请的开发阶段过早,另外4个申请中产品含有医疗器械部分(现在EMA已不再因为有器械成分而拒绝PSA申请),而剩余3个申请则是因为”更多不同或细微的原因”导致两个监管机构认为PSA不适合该产品。
此次回顾还深入研究了2020年的7份被接受的申请的时间线数据。对于这7份申请,从提出PSA申请到获批平均用时在13个日历日左右,会议材料准备和监管机构确认平均用时为67个日历日,从两个监管机构对会议材料的审核到召开三方会议并获得相关会议纪要平均需要79个日历日。这些数据为开发者准备PSA的时间线提供有用的参考。
给开发者的小贴士
在报告的最后,FDA和EMA还为正在考虑申请PSA项目的开发者提供了如下的建议。
首先,应在已经开始与FDA进行pre-IND会议或IND申请流程时才申请PSA。在监管机构了解其的产品发展计划的基础和背景的前提下,将其在PSA中提出的问题集中在产品全球同步开发的具体细节问题上。
此外,他们还建议开发者熟悉现有的指南,了解EMA与FDA在哪些方面存在一致性,PSA项目可能最适合于尚未在已发布的指南中得到讨论的 “创新产品“或”新的科学概念“或”新的监管概念”。
最后,他们建议开发者在提出PSA申请前考虑其产品为公共卫生带来的益处,因为PSA需要两个机构投入额外的资源,因此该项目的重点是解决未满足的医疗需求,聚焦罕见病、儿科人群或其他对患者和公共健康有着重要意义的领域的产品。开发者一定要在申请信中清晰地解释产品如何能够为公共健康带来益处和潜在价值。
参考内容
[1] RAPS.org “EMA-FDA parallel scientific advice program has ‘limited’ uptake“, Mar 14, 2023
[2] “EMA‑FDA Parallel Scientifc Advice: Optimizing Development of Medicines in the Global Age”, Therapeutic Innovation & Regulatory Science, Feb 10, 2023
发布于:2023年3月24日



