
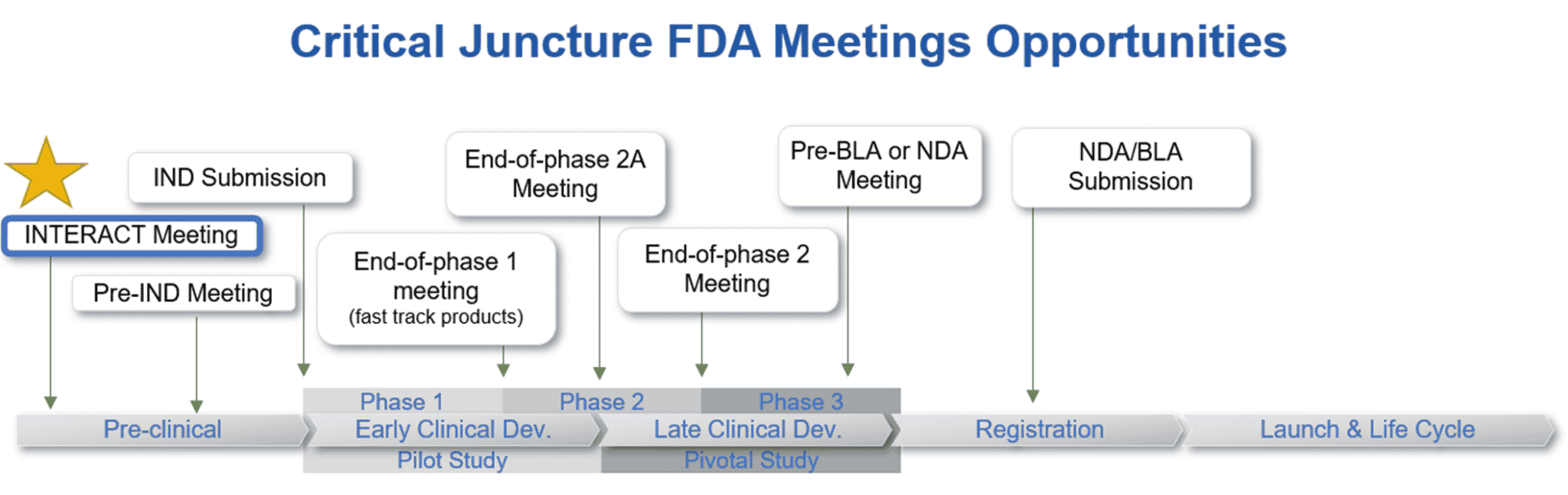
会议内容
INTERACT(INitial Targeted Engagement for Regulatory Advice on CBER producTs)会议是创新研类生物制品的申办方与 CBER 之间举行的非正式会议,旨在从 FDA 获得关于CMC、药理学/毒理学和/或临床方案方面的非约束性建议。
INTERACT 会议并非旨在取代 Pre-IND 会议,也不是申请该会议的先决条件。基于这些早期互动,CBER 能由此了解该创新性类产品的开发可能会带来与未知的安全性、复杂的制造工艺、技术和问题、创新性设备以及尖端检测方法的使用相关的独特挑战。
CDER 目前不举行类似的会议,但在 2023 财年重新授权 PDUFA VII 时,这些会议将被启动。届时所有 INTERACT 会议将成为正式的 PDUFA 会议。
INTERACT 会议可以:
- 协助申办方进行早期产品表征和临床前概念验证研究
- 对创新型设备/仪器进行讨论
- 与申办方分享有关早期临床试验总体设计要素
- 指出申办方在药物开发过程中所需解决的关键问题或缺陷
会议时间
INTERACT 会议适用于已经开始药物开发过程,但尚未达到适合召开pre-IND会议的阶段的产品。在申请召开 INTERACT 会议之前,申办方应选择特定的拟进入临床研究的产品或生物制品研制策略。
申请流程
在与 FDA 进行的第一次会议之前,必须向CBER申请一个 PIND 编号。建议在提交会议申请前 30 天,通过发送电子邮件 ( CBERRIB@fda.hhs.gov) 向CBER进行申请。
此外,在申请召开 INTERACT 会议之前,应准备一份长度不超过 50 页的会议资料,其中包括以下信息:
- 对产品和其治疗或预防的适应症的描述
- 有关迄今为止产品开发和任何未来开发计划的信息摘要(如适用)
- 一个问题列表,以及每个问题的背景或者讨论原因。这些问题应按以下类别进行分组(注意:有关组合产品的问题应归为一类):
- CMC
- 药理学/毒理学
- 临床
- 为讨论主题和问题提供数据概述
- 所有申办方参与者的名单(包括咨询顾问和译员),需要囊括他们的头衔和从属机构信息
- 申办方可以选择建议会议召开的时间,包括列出无法进行会议的时间段
会议安排 & 注意事项
如果会议申请获得批准,通常会在收到申请后的 21 个自然日内进行安排, 并在收到申请后的 90 个自然日内,通过电话会议召开,持续时间通常为 1 小时。
CBER 将最晚在会议召开的前 1 天向会议资料包中包含的申办方所提出的问题发送书面答复,以促进会议中的沟通进程。额外问题将一概不会被接受和讨论。如果申办方认为 CBER 提供的书面答复足以解答他们的疑惑,无须进行进一步讨论,他们可以选择取消会议。
在 INTERACT 会议期间,双方的沟通将着眼于会议材料中提交的问题。CBER 在此期间提供的建议是非正式的,且不具有任何约束力,因此不会向申办方发送正式会议纪要。此外,由申办方撰写并发送给 CBER 的任何会议纪要都不会被审核,或进行准确性审查。
如果会议申请被拒绝,申办方将被告知原因。这些原因可能包括:
- INTERACT 会议申请中未附带任何材料。
- 会议材料严重不足,对提供建设性反馈存在明显的限制。
- 申办方所要求得到的反馈内容超出了 INTERACT 会议的范围。
- 对于 INTERACT 会议而言,申办方的产品开发阶段要么为时过早,要么过于深入。在这种情况下,CBER 通常向申办者建议提交其他类型的会议申请。
- 之前已经举行过一次相同目的的会议,且CBER无法提供实质性的新建议。
- 申办方所要求得到的反馈内容不适用于与 CBER 之间开展的会议。
发布于:2022年7月25日




