
关于PSA
作为创新医疗产品研发的主要推力,全球范围内的主要市场中不断涌现出新的中小型企业,他们致力于未满足的医疗需求,利用新兴技术手段加速药物发现和开发过程,设计并开发全新的药品和治疗设备,以改善诊断、治疗和看护等各方面医疗过程。
然而创新产品研发需要大量的时间和资本投入。对于中小型企业而言,他们往往缺乏稳定的资金支持,在药政策略和注册运营方面缺乏内部资源和专业人才,以及缺乏与监管和卫生当局沟通经验等需要通过外部支持解决的问题。
本文将聚焦这些问题,简述欧盟作为世界主要医药市场之一,其监管部门对于中小(微)型企业(micro, small or medium-sized enterprise,SME)在政策、监管程序和财务方面提供的支持,以及SME应如何利用并提高自身的产品开发效率。
欧盟SME药物开发数据解析
如今SME已成为全球范围内创新药物开发的重要推动力量。
仅在欧盟地区,据EMA官方统计:
- 2005年至2020年,有130多种由SME开发的创新药物被批准在欧洲上市。
- 2016年至2020年,每10个入选EMA PRIME(Priority medicines,优先药物计划)的药物中,就有4个药物由SME开发。
- 在2020 年上市的人用药物近20%是由SME开发的,其中一半为罕见疾病开发。
政策支持
欧盟委员会在2005年出台了Commission Regulation (EC) No 2049/2005,该法规对SME进行了定义,并旨在为这些企业提供更多的发展空间与机会。推动欧洲地区乃至全球创新药物的开发。
按照法规要求,EMA专门设置了SME办公室,符合SME资格的企业可以就EMA相关法规、行政要求或程序问题寻求该办公室的帮助,如:
- 讨论开发监管策略,了解可用的程序,指南和激励措施
- 帮助将产品信息翻译为欧盟的官方语言
- 阅读SME办公室编写的新闻时事通讯
- 参加官方组织的培训活动
- 通过儿科研究欧洲网络(Enpr-EMA)获得相关支持
财务支持
获得SME资格的企业还能够获得来自财务上的支持,即产品上市许可前后一系列监管程序费用的减免,如:
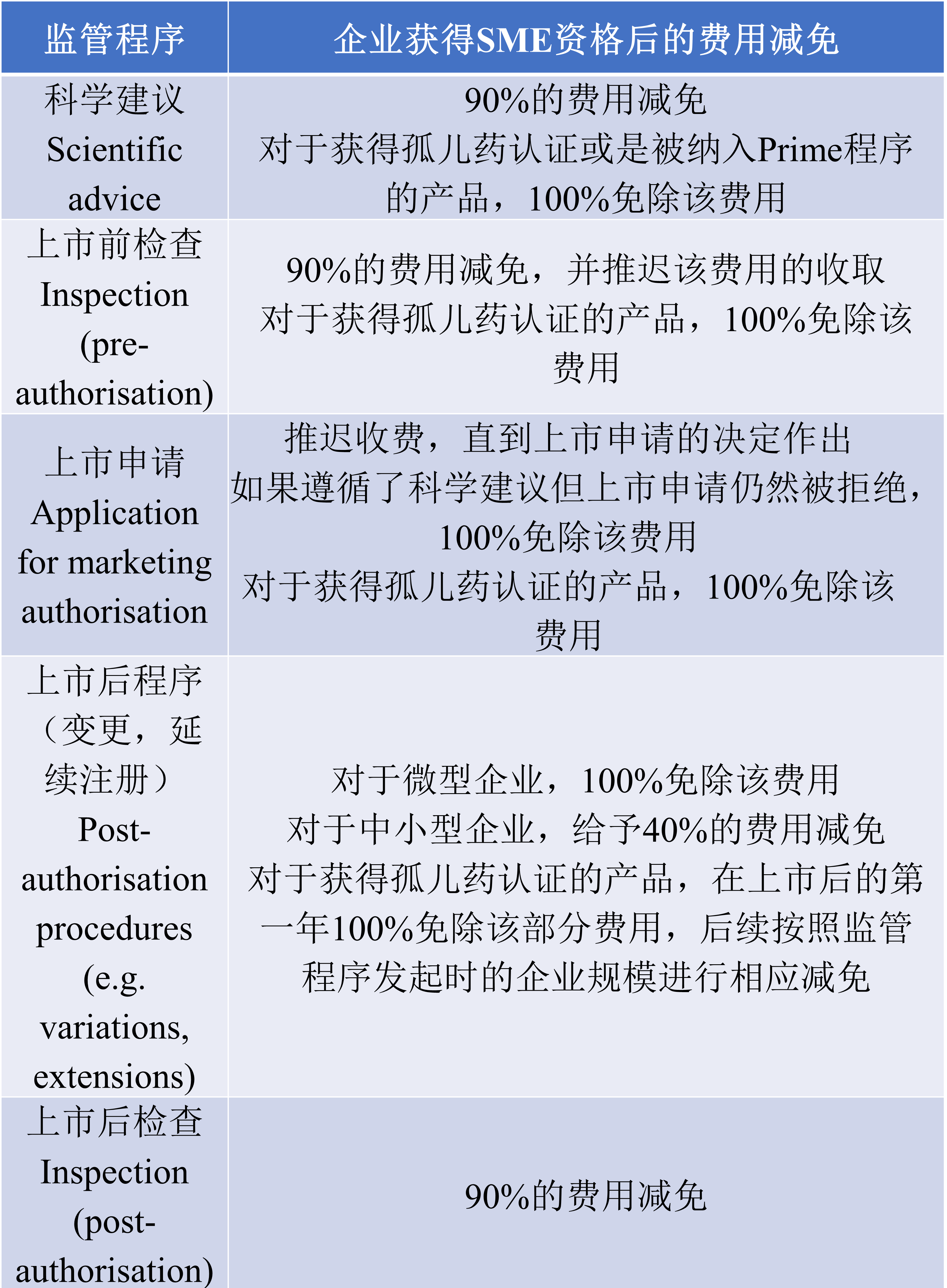
纳入资格
- 公司员工不超过250人
- 年营业额不超过5000万欧元
- 年资产负债表总额不超过4300万欧元。
发布于:2024年1月15日




